
联系方式:
地址:浙江省杭州市钱塘区下沙街道学林街1392号
热线:4009097985
电话:15350114126 (吴经理)
邮箱:1533423978@qq.com
网址:kaerucoffee.com
干货分享‖一文读懂流式细胞术
流式细胞术广泛用于分析细胞表面和细胞内分子的表达、鉴定并确定异质细胞群中的不同细胞类型、评估分离亚群的纯度以及分析细胞大小和容积。
主要用于测定荧光标记的抗体检测蛋白产生的荧光强度,或结合了特定细胞分子的配体,如碘化丙啶与 DNA 的结合。
其染色过程包括从细胞培养物或组织样品制备单细胞悬液。然后将获得的细胞培养在包含未标记或荧光标记抗体的试管或多孔板中,再用流式细胞仪分析。
流式细胞仪主要有两型:
临床型(又称:小型机、台式机)和综合型(又称:大型机、分析型)。BECKMAN-COULTER公司新产品为EPICS ALTRA和EPICS XL/XL-MCL,B-D公司新产品为FACS Vantage和FACS Calibur。EPICS XL/XL-MCL和FACS Calibur是临床型;EPICS ALTRA和 FACS Vantage是综合型,除具备检测分析功能外,还具有细胞分选功能,多用于科学研究。
流式细胞仪主要技术指标
1.流式细胞仪的分析速度:
一般流式细胞仪每秒检测1000~5000个细胞,大型机可达每秒上万个细胞;
2.式细胞仪的荧光检测灵敏度:
一般能测出单个细胞上<600个荧光分子,两个细胞间的荧光差>5%即可区分;
3.前向角散射(FSC)光检测灵敏度:
前向角散射(FSC)反映被测细胞的大小,一般流式细胞仪能够测量到0.2μm~0.5μm;
4.流式细胞仪的分辨率:
通常用变异系数CV值来表示,一般流式细胞仪能够达到<2.0%,这也是测量标本前用荧光微球调整仪器时要求需要达到的;
5.流式细胞仪的分选速度:
一般流式细胞仪分选速度>1000个/秒,分选细胞纯度可达99%以上;
流式细胞仪:射流
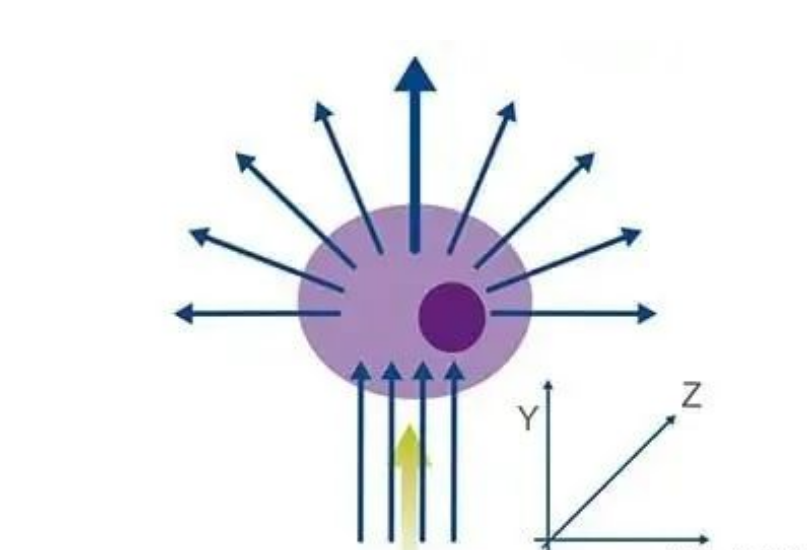
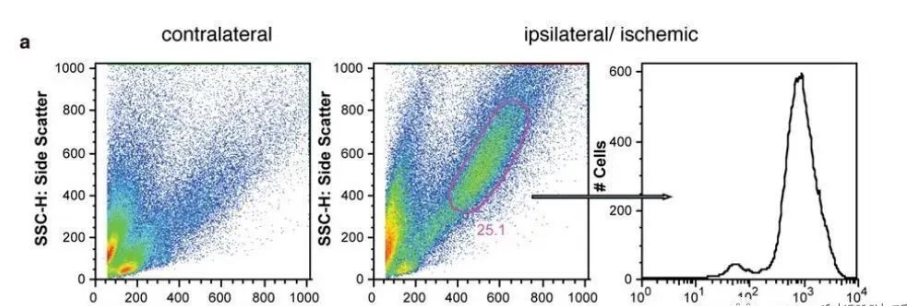
图 1.流式细胞仪概览。鞘液使细胞悬液聚拢,依次通过激光束,一次仅一个细胞。检测器会检测前向和侧向散射光,以及染色细胞发射的荧光。
当细胞悬液通过流式细胞仪时,从小喷嘴中流出的细胞悬液在鞘液的流体力学作用下向中心聚拢。形成的细流可使细胞依次通过激光束,一次仅一个细胞(图 1)。
当细胞通过激光束时,检测器会检测细胞或颗粒的散射光。前面的检测器检测前向散射光 (FS),放置在侧面的多个检测器检测侧向散射光 (SS),荧光检测器则检测被染色的细胞或颗粒发射的荧光。
流式细胞仪:前向和侧向散射光的测定
细胞或颗粒通过光束并使光散射,这些散射光将以 FS 或 SS 的形式检测。FS 与细胞的大小相关,SS 则与细胞颗粒度成比例。因此,通常可根据细胞大小和颗粒度差异区分细胞群。
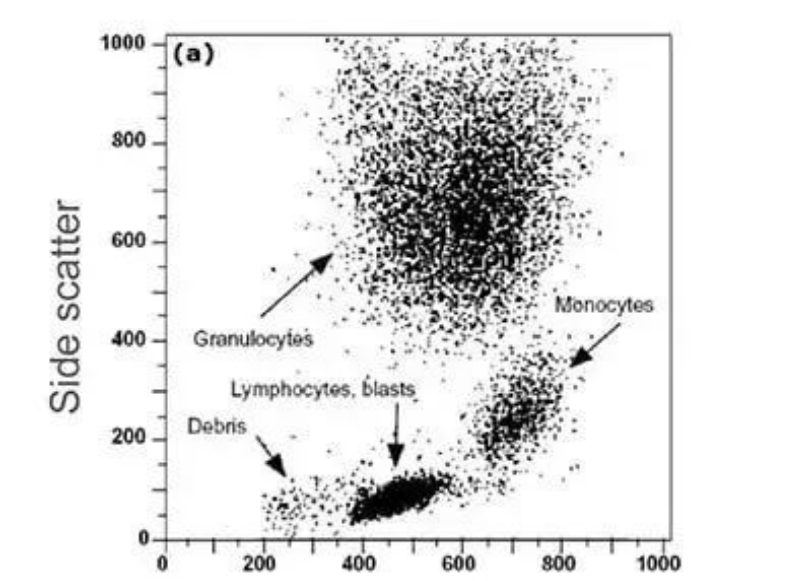
图 2.绿色激光打到细胞上时的光散射。光的散射方向与细胞大小和颗粒度有关。
血液样本流经流式细胞仪的情况可有力地说明散射光与细胞的关系。
尺寸和颗粒度较大的粒细胞形成一个较大的细胞群,SS 和 FS 都很强,单核细胞尺寸较大,但其颗粒度较小,因此形成一个单独的群,FS 较强但 SS 较弱,较小的淋巴细胞和淋巴母细胞也行成一个单独的群,FS 较弱。由于这两种细胞都不是颗粒细胞,因此产生的 SS 也较弱。
因此,根据不同的 FS 和 SS 可将这些细胞分成不同的细胞群。
FS 与 SS 散点图。每一个散点到被流式细胞仪检测到的一个单细胞,不同细胞群的特征位置依据细胞大小和颗粒度确定。参考图片出处:Riley 和 Idowu(流式细胞术的原理和应用)。
流式细胞仪:散射光和荧光的测定
与根据 FS 和 SS 区分细胞群类似,可根据是否表达特定蛋白区分细胞。这种情况下,通常使用荧光染料对目标蛋白进行染色。用于检测目标蛋白的荧光染料被相应激发波长的激光激发后会发射荧光。这些被荧光染色的细胞或颗粒会被单独检测。
受流式细胞仪中一组滤光片和镜子的作用,前向和侧向散射光以及染色细胞发射的荧光会被分成既定的波长并分配通道。荧光会被过滤,以使各传感器仅检测特定波长的荧光。这些传感器称为光电倍增管 (PMT)。
荧光会被过滤,以使各 PMT 仅检测特定波长的光。PMT 会将光子能量转换成电信号,即电压。
FITC(异硫氰酸荧光素)通道中,PMT 仅检测 FITC 发射的波长在 519 nm 附近的光。PE 通道中,PMT 仅检测 PE(藻红蛋白)发射的波长在 575 nm 附近的光。各 PMT 还会检测其他的荧光染料,这些染料发射的荧光波长与其要检测的荧光染料发射的荧光波长相似。
流式细胞仪中装有一组滤光片,以将相应波长的光子引导至特定的 PMT 上(图 5)。
流式细胞仪中的滤光片。带通 (BP) 滤光片允许较小范围波长的光子通过,短通 (SP) 滤光片允许特定波长以下的光子通过,
长通 (LP) 滤光片则允许特定波长以上的光子通过。双色向滤光片/镜子(如双色向 LP 镜子)面向光束 45° 角放置。
对于长通双色向滤光片,特定波长以上的光子可直接通过,特定波长以下的光子成 90° 角反射。
信号测定
当带荧光的细胞通过激光束时,会随着时间产生发射光峰或脉冲。它们将被 PMT 检测并转换成电压脉冲,这就是事件。流式细胞仪会检测总脉冲面积,并将测得的电压脉冲直接与该事件的荧光强度相关联。
PMT 将检测荧光细胞每次释放的光子产生的电压脉冲面积。当没有荧光标记的细胞通过光学元件时,不会发射光子,也不会检测到信号。当荧光标记的细胞通过光学元件时,会受到激光照射并发射光子,因此检测到的电压强度会逐渐增强。随着荧光细胞逐渐通过激光束,会随着时间变化产生一段电压脉冲。
通过积分各时刻脉冲的值得到脉高冲面积,这由模数转换器 (ADC) 的速度决定,也就是 10 MHz(即每秒 1000 万次或每微秒 10 次)。
依据事件的脉冲强度(脉冲面积)为事件分配通道。增大通过 PMT 的电压可以对信号进行放大。
利用通道号和事件数绘制的单参数直方图。X 轴为用对数表示的通道。
根据测得的信号强度为每一事件分配通道号;荧光强度越高,事件的通道号就越大。
阴性和阳性结果的荧光强度测定值。左侧的阴性结果表明没有染色的细胞且各事件的荧光强度都很低,右侧的阳性结果表明存在大量荧光强度很高的事件。
在阳性结果中,可以看出阴性对照和阳性样品间强度结果有所不同(图 9)。
人 PBMC 细胞对单核细胞设门的抗-CCR2 抗体 (ab21667) 染色结果。数据来自匿名 Abreview
抗体染色
直接染色:
在直接免疫荧光染色中,将细胞与直接偶联到荧光染料(如 FITC)的抗体一同培养。该染色法仅需一步抗体培养,且消除了二抗的非特异性结合。
对于包含二抗的大型抗体 - 荧光染料复合物可能被捕获而导致非特异性结合或无法进入细胞防止一抗检测的细胞内染色非常适用。
间接染色:
在间接染色中,一抗未用荧光标记,而是通过荧光标记的二抗进行检测。第二种试剂可以是能与一抗特异性结合的抗体。此外,还可使用亲和素 - 生物素体系,这种方法将抗体偶联到生物素上,再通过荧光染料标记的亲和素进行检测。
由于目前可用的偶联抗体种类很多,这种方法可以将多种不同靶标产生的未偶联一抗用于与荧光标记的二抗结合,以进行 FACS 分析。这大大提高了研究人员的可选靶标蛋白范围。
细胞内染色:
用于流式细胞术的细胞内抗原染色方案取决于可让抗体接近内部细胞蛋白的固定和透化方法。无论何种情况,成功的染色都离不开通过抗体滴定进行的实验条件优化、使用适合的对照正确设置流式细胞仪以及优化的固定和透化步骤。
分泌蛋白的检测:
分泌蛋白的检测十分困难,因为蛋白会在检测前从细胞中释放出来且可能降解。高尔基体阻断剂(如布雷非德菌素A)可用于抑制表达蛋白的分泌,使其仍保留在高尔基体中。然后再用细胞内染色法检测靶标蛋白。
荧光染料偶联剂的选择
给定的抗体能否从阴性信号中分辨阳性信号取决于所用的荧光染料偶联剂。
各荧光染料的相对强度一般指导原则是,从亮到暗依次为:PE、PE-Cy 7、PE-Cy5、APC、APC-Cy7、Alexa Fluor 647®、Alexa Fluor 700®、FITC、Pacific Blue 和 Alexa Fluor 488®。这是一般排序,个别抗体的相对强度可能有所差异。
高显示的抗原通常可被检测且与阴性对照区分开来,无论使用何种荧光染料。显示较少的抗原需要较亮的 PE 或 APC 偶联剂提供的高信号背景比,以将阳性细胞完全染色的细胞中区分开来。
相对荧光染料强度取决于使用的仪器,因为不同仪器中的激光和滤光片组合会有所差异。因此,需要选用合适的 FACS 仪器。


 扫码微信咨询
扫码微信咨询

